MATERIA
La materia es todo lo que ocupa un lugar en el universo. Es todo aquello que se forma a partir de átomos o moléculas, con la propiedad de estar en estado sólido, líquido o gaseoso. Son ejemplos de materia las piedras, la madera, los huesos, el plástico, el vidrio, el aire y el agua. Al observar un paisaje pueden verse pájaros, árboles, un río, un caballo pastoreando, flores, etc. Todas esas cosas forman parte de la naturaleza y se pueden ver y tocar. Esa característica común (visible y palpable) que tienen todos los objetos se denomina materia. Es decir, la materia es lo que forman las cosas que tocamos y vemos.
La materia tiene volumen porque ocupa un lugar en el espacio. Además tiene masa, que es la cantidad de materia que posee un objeto y que se puede medir con una balanza. La materia, a diferencia de los objetos o cuerpos, no está limitada por la forma ni por el tamaño. A su vez, los objetos o cuerpos (por ejemplo una caja) pueden estar construidos por diferentes materiales (cartón, metal, madera, plástico). Para diferenciar cada uno de estos casos particulares de la materia les denominaremos sustancias o materiales. El cartón, el metal, el plástico y la madera son sustancias.
En el universo, la materia suele encontrarse en tres estados diferentes de agregación: sólido (hierro, madera), líquido (agua de mar) y gaseoso (aire atmosférico). En estos tres estados de agregación se observan las siguientes características:
1) La materia está formada por pequeñas partículas.
2) Esas partículas están en constante movimiento (en los gases más que en los líquidos y sólidos).
3) Hay fuerzas de atracción entre las partículas que forman la materia (en los sólidos más que en líquidos y gases).
Esas partículas, que son pequeñísimas y que forman parte de la materia se denominan átomos.
ÁTOMO
Un átomo es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos. Los átomos están formados por un núcleo que contiene dos tipos de partículas: los protones (tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica). Ambas partículas tienen una masa similar. Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica negativa y una masa muchísimo más pequeña que la correspondiente a los protones y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía.
MOLÉCULA
Es la menor porción de una sustancia que puede existir en estado libre y conservar las propiedades de dicha sustancia.
La molécula es una estructura formada a partir de la unión de dos o más átomos que comparten electrones.
En síntesis, la materia está formada por partes muy pequeñas llamadas átomos. Los átomos se reúnen para constituir moléculas. A su vez, las moléculas se unen para formar sustancias.
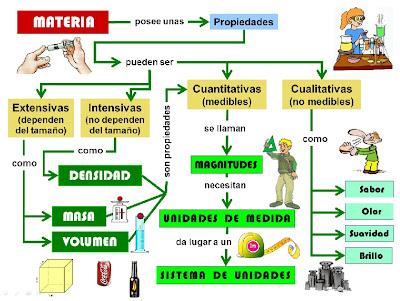
PROPIEDADES DE LA MATERIA
Se clasifican en dos grandes grupos: generales y especificas.
I. Propiedades Generales:
Son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
Masa: Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta.
Volumen: Un cuerpo ocupa un lugar en el espacio
Peso: Es la acción de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaña o en la Luna, el peso de los cuerpos disminuye.
Divisibilidad: Es la propiedad que tiene cualquier cuerpo de poder dividirse en pedazos más pequeños, hasta llegar a las moléculas y los átomos.
Porosidad: Como los cuerpos están formados por partículas diminutas, éstas dejan entre sí espacios vacíos llamados poros.
La inercia: Es una propiedad por la que todos los cuerpos tienden a mantenerse en su estado de reposo o movimiento.
La impenetrabilidad: Es la imposibilidad de que dos cuerpos distintos ocupen el mismo espacio simultáneamente.
La movilidad: Es la capacidad que tiene un cuerpo de cambiar su posición como consecuencia de su interacción con otros.
Elasticidad: Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la acción de la fuerza. La elasticidad tiene un límite, si se sobrepasa el cuerpo sufre una deformación permanente o se rompe. Hay cuerpos especiales en los cuales se nota esta propiedad, como en una liga, en la hoja de un cuchillo; en otros, la elasticidad se manifiesta poco, como en el vidrio o en la porcelana.
II. Propiedades Especificas:
Son las propiedades peculiares que caracterizan a cada sustancia, permiten su diferenciación con otra y su identificación.
Entre estas propiedades tenemos: densidad, punto de ebullición, punto de fusión, índice de refracción de luz, dureza, tenacidad, ductibilidad, maleabilidad, solubilidad, reactividad, actividad óptica, energía de ionización, electronegatividad, acidez, basicidad, calor latente de fusión, calor latente de evaporización, etc.
Las propiedades especificas pueden ser químicas o físicas dependiendo si se manifiestan con o sin alteración en su composición interna o molecular.
1. Propiedades Físicas: Son aquellas propiedades que impresionan nuestros sentidos sin alterar su composición interna o molecular.
Ejemplos: densidad, estado físico (solido, liquido, gaseoso), propiedades organolépticas (color, olor, sabor), temperatura de ebullición, punto de fusion, solubilidad, dureza, conductividad eléctrica, conductividad calorífica, calor latente de fusión, etc.
A su vez las propiedades físicas pueden ser extensivas o intensivas.
Propiedades Extensivas: el valor medido de estas propiedades depende de la masa. Por ejemplo: inercia, peso, área, volumen, presión de gas, calor ganado y perdido, etc.
Propiedades Intensivas: el valor medido de estas propiedades no depende de la masa. Por ejemplo: densidad, temperatura de ebullición, color, olor, sabor, calor latente de fusión, reactividad, energía de ionización, electronegatividad, molécula gramo, átomo gramo, equivalente gramo, etc.
2. Propiedades Químicas: son aquellas propiedades que se manifiestan al alterar su estructura interna o molecular, cuando interactúan con otras sustancias
Ejemplos: El Fe se oxida a temperatura ambiental y el Oro no se oxida
AMPLIAR INFORMACIÓN EN LOS SIGUIENTES VINCULOS:
http://alextecnoeso.files.wordpress.com/2011/10/tema-1-propiedades-y-estados-de-la-materia-alumnos.pdf
http://recursostic.educacion.es/newton/web/materiales_didacticos/materia/aulamateria.pdf