Fuerza es toda causa capaz de modificar el estado de movimiento o de reposo de un cuerpo o de producir en él una deformación.
La fuerza es una magnitud vectorial: se representa por una flecha (vector) y necesitamos conocer no sólo su módulo, sino también su dirección, sentido y punto de aplicación.
Su unidad es el Newton (1kg pesa 9,8 N en un lugar en que la gravedad es 9,8 m/s2).
Origen
Una interacción entre dos objetos siempre produce dos fuerzas iguales y opuestas, aplicadas una en cada objeto.
Las interacciones pueden ser a distancia como la gravitatoria y la electromagnética o por contacto
(como las originadas en un choque). Debido a que no se anulan las fuerzas originadas en los choques, porque están aplicadas una en cada objeto, éstos rebotan o se deforman.
Efectos que producen
Las fuerzas producen deformaciones (como por ejemplo sus efectos en muelles, gomas, carrocerías, etc.) y también cambios de velocidad (aceleración).
Una fuerza actuando, ya sea durante un tiempo pequeño ("golpe seco" o durante poco recorrido) o
durante mucho tiempo, produce una aceleración que cambia el valor de la velocidad y/o su sentido.
Una fuerza, cuya dirección de aplicación no pasa por el centro de gravedad de un objeto libre, le produce un giro y una traslación. Si el cuerpo está sujeto por un punto y la dirección de la fuerza aplicada no pasa por ese punto, también girará.
Las Fuerzas y sus efectos from Arturo Andrés Martínez
Transformaciones de la energía
La Energía se encuentra en una constante transformación, pasando de unas formas a otras. La
energía siempre pasa de formas "más útiles" a formas "menos útiles". La utilidad se refiere a capacidad para poder realizar un trabajo.
Las transformaciones de energía están presentes en todos los fenómenos que ocurren en la naturaleza.
Por ejemplo, el motor de un carro produce un cambio de energía química (contenida en la gasolina y liberada en su combustión) en energía cinética.
Concepto de energía
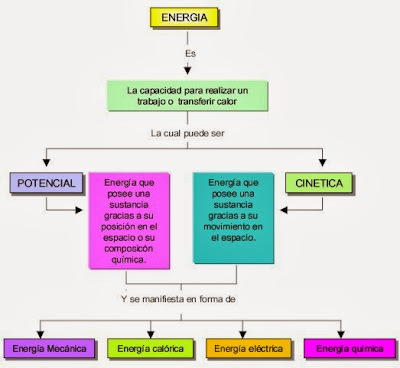
La energía es la capacidad que tienen los cuerpos para producir cambios en ellos mismos o en otros cuerpos.
La energía no es la causa de los cambios.
Las causas de los cambios son las interacciones y, su consecuencia, las transferencias de energía.
Unidades de energía
- En el Sistema Internacional (S. I.) la energía se mide en julios (J). 1 J es, aproximadamente, la energía que hay que emplear para elevar 1 metro un cuerpo de 100 gramos.
- Caloría (cal): Cantidad de energía necesaria para aumentar 1 ºC la temperatura de 1 g de agua.
1 cal = 4,18 J.
- Kilovatio-hora (kWh): Es la energía desarrollada por la potencia de 1000 vatios durante 1 hora.
1 kWh = 3.600.000 J.
- Tonelada equivalente de carbón: (tec): Es la energía que se obtiene al quemar 1000 kg de carbón. 1 tec = 29.300.000 J
- Tonelada equivalente de petróleo (tep): Es la energía que se obtiene al quemar 1000 kg de petróleo. 1 tep =41900000 J
- Kilojulio y kilocaloría (kJ y kcal): Son, respectivamente, 1000 J y 1000 cal. Se usan con frecuencia debido a los valores tan pequeños de J y cal.
Tipos de energía
-La energía cinética: es la energía que tienen los cuerpos por el hecho de estar en movimiento. La energía cinética se mide en julios (J), la masa en kilogramos (kg) y la velocidad en metros por segundo.(m/s).
La energía cinética del viento es llamada energía eólica.
-Energía potencial: Es la energía que tienen los cuerpos por ocupar una determinada posición. Podemos hablar de energía potencial gravitatoria y de energía potencial elástica. La energía potencial gravitatoria es la energía que tiene un cuerpo por estar situado a una cierta altura sobre la superficie terrestre.La energía potencial se mide en julios (J), la masa en kilogramos (kg), la aceleración de la gravedad en metros por segundo al cuadrado (m/s2) y la altura en metros (m).
Por ejemplo, una piedra al borde de un precipicio tiene energía potencial: si cayera, ejercería una
fuerza que produciría una deformación en el suelo.
La energía potencial elástica es la energía que tiene un cuerpo que sufre una deformación. Su valor depende de la constante de elasticidad del cuerpo y de lo que se ha deformado . La energía potencial elástica se mide en julios (J), la constante elástica en newtons/metro (N/m) y el alargamiento en metros (m).
Por ejemplo, cuando se estira una goma elástica, almacena energía potencial elástica. En el momento en que se suelta, la goma tiende a recuperar su posición y libera la energía. En esto se basa la forma de actuar de un tirachinas.
-La Energía térmica: se debe al movimiento de las partículas que constituyen la materia. Un cuerpo a baja temperatura tendrá menos energía térmica que otro que esté a mayor temperatura. Un cuerpo posee mayor cantidad de energía térmica cuanto más rápido es el movimiento de sus partículas.
-Energía eléctrica: es causada por el movimiento de las cargas eléctricas en el interior de los materiales conductores. Esta energía produce, fundamentalmente, tres efectos: luminoso, térmico y
magnético. Por ejemplo, la transportada por la corriente eléctrica en nuestras casas y que se manifiesta al encender una bombilla.
-La Energía radiante: es la que poseen las ondas electromagnéticas como la luz visible, las ondas de radio, los rayos ultravioleta (UV), los rayos infrarrojo (IR), etc. La característica principal de esta energía es que se puede propagar en el vacío, sin necesidad de soporte material alguno. Ejemplo: La energía que proporciona el Sol y que nos llega a la Tierra en forma de luz y calor.
-Energía química: Es la energía que poseen las sustancias químicas y puede ponerse de manifiesto mediante una reacción química.
-Energía nuclear: Es la energía que proviene de las reacciones nucleares o de la desintegración de los núcleos de algunos átomos.
-La Energía hidráulica: es la producida por el agua retenida en embalses o pantanos a gran altura (que posee energía potencial gravitatoria).
Transformaciones de la energía
La Energía se encuentra en una constante transformación, pasando de unas formas a otras. La
energía siempre pasa de formas "más útiles" a formas "menos útiles". La utilidad se refiere a capacidad para poder realizar un trabajo.
Las transformaciones de energía están presentes en todos los fenómenos que ocurren en la naturaleza.
Por ejemplo, el motor de un carro produce un cambio de energía química (contenida en la gasolina y liberada en su combustión) en energía cinética.
Concepto de trabajo
El Trabajo es una de las formas de transferencia (cuando dos cuerpos intercambian energía, lo hacen, o bien de forma mecánica, mediante la realización de un trabajo, o bien de forma térmica, mediante el calor) de energía entre los cuerpos. Para realizar un trabajo es preciso ejercer una fuerza sobre un cuerpo y que éste se desplace.
El trabajo es una magnitud física escalar que se representa con la letra \ W (del inglés Work) y se expresa en unidades de energía, esto es en julios o joules (J) en el Sistema Internacional de Unidades.
Donde F es el módulo de la fuerza, d es el desplazamiento y \alpha es el ángulo que forman entre sí el vector fuerza y el vector desplazamiento.























.jpg)
.png)

















